温和低毒
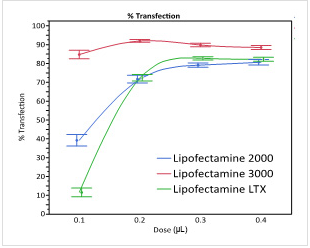
图3.采用指定剂量的每种试剂,通过绿色荧光蛋白(GFP)表达载体,以96孔形式转染HeLa细胞。在转染后48小时,采用流式细胞仪进行分析,以测定百分比形式的转染效率以及GFP表达强度。相对于Lipofectamine® 2000试剂和Lipofectamine® LTX试剂,Lipofectamine® 3000试剂表现出了更高的转染效率和蛋白表达水平。
增强您的癌症研究工作
Lipofectamine® 3000试剂与畅销的Lipofectamine® 2000试剂相比,在多种组织来源的癌症细胞中具有更高的转染效率。在所选的癌症细胞系中,使用Lipofectamine®
2000仅有25%被认为易于转染(>50%的转染效率),而使用Lipofectamine®
3000却有60%的细胞系是易于转染的。
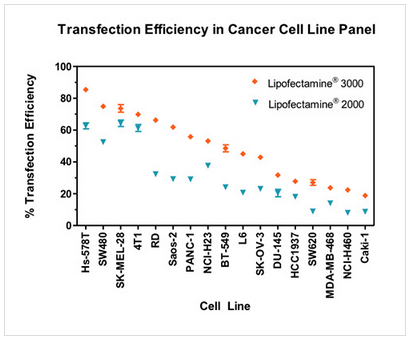
图4. 采用Lipofectamine® 2000试剂和Lipofectamine® 3000试剂将表达GFP的质粒转染至17种癌症细胞系中,利用各试剂推荐的实验方案,在24孔板中进行转染,每孔质粒用量为0.5µg。转染48小时后分析GFP表达情况。重复检测3次,数据点显示平均转染效率 + 标准差。
生成诱导多能干细胞(iPSCs)
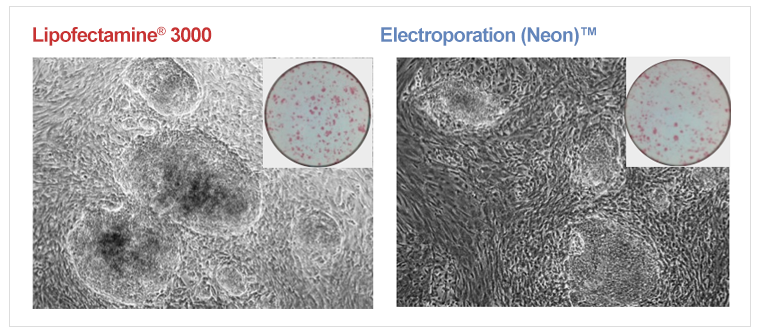
图5. 结果来自于明场显微镜,(A) Lipofectamine® 3000和 (B) Neon® 转染系统都表明在生成iPSC细胞群落时重编程成功了。使用碱性磷酸酶进行末端染色。
改善基因组编辑结果
开发Lipofectamine® 3000试剂,旨在突破输送技术的界限,促进生物相关系统内的新技术发展,例如基因组编辑。通过这一新试剂,GeneArt® TALs 和 CRISPR 可以靶向HepG2和U2OS细胞内的AAVS1位点,同时表现出更佳的转染效率、平均荧光强度和基因组切割效果。这些改进之处有助于最大限度减少繁重的下游工作,更便于进行干细胞处理,增强转基因在细胞基因组中的位点特异性插入。
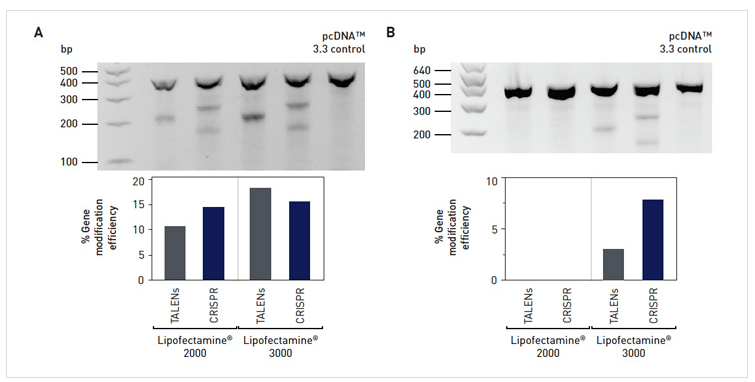
图6. GeneArt® TALs 和 CRISPRs的切割效率。TAL和CRISPR靶向(A) U2OS和(B) HepG2细胞系中的AAVS1位点。采用GeneArt®基因组切割检测试剂盒分析切割效率。
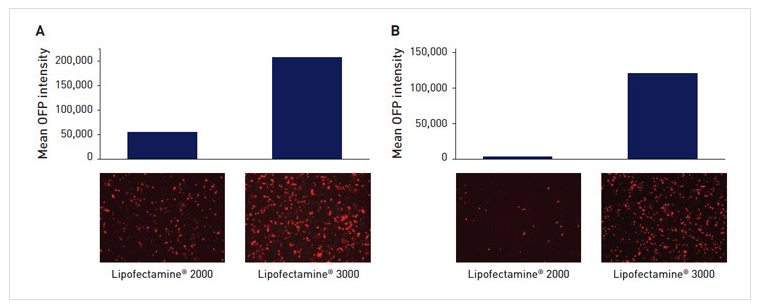
图7. 使用CRISPR载体时的转染效率和蛋白表达。该载体含有OFP报告基因,并采用Lipofectamine® 2000或Lipofectamine® 3000转染试剂转染到(A) U2OS和(B) HepG2细胞系中。柱状图所示为报告基因的表达。图片所示为相应细胞表达OFP的荧光图。
转染干细胞
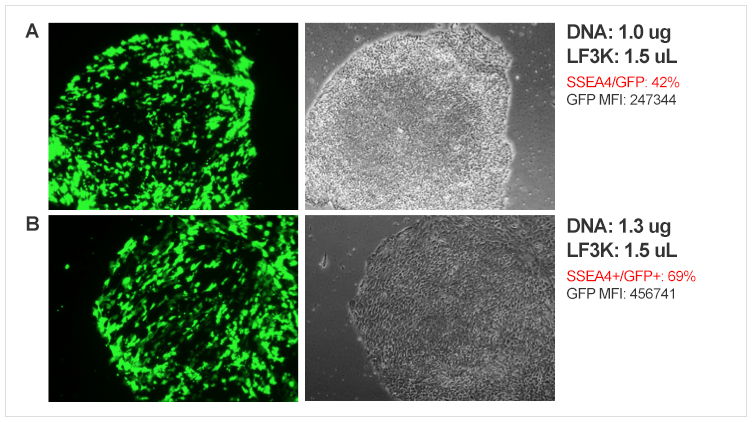
图8. 使用Lipofectamine ® 3000转染H9干细胞 (A)或iPSC (B)