
突破性的体内转染试剂
Invivofectamine® 3.0试剂是一种突破性的体内RNAi输送试剂,可大幅改善实验性能,使用微克级的siRNA即可达到高达85%的敲低效果。
-
易于使用—siRNA复合物只需数个步骤即可完成输送
-
高效、靶向敲低—在实验靶标中可观察到高达85%的敲低效果
-
siRNA样品需求量更少—相比过去的试剂,最多可少用90%的siRNA完成有效敲低
-
持续敲低能力—在单次注射后可观察到更长的敲低时间
-
低毒性—复合物表现出极低的体内毒性
易于使用
用于转染的Invivofectamine®3.0试剂及RNAi复合物非常容易获得:只需简单地混合,并进行孵育(30min)、稀释、及注射即可(图1)。
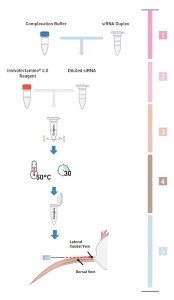
图1. 仅需简单几步快速制备可直接用于注射的RNAi/Invivofectamine® 3.0试剂复合物。
高效、靶向敲低
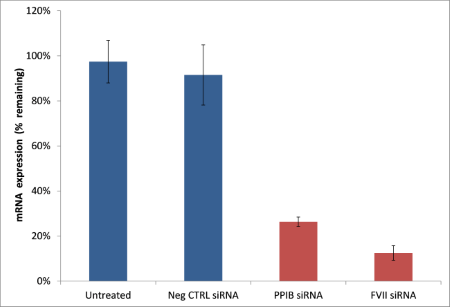
图2.使用Invivofectamine® 3.0试剂可在单次静脉注射后即可在肝脏中实现靶向敲低。 Invivofectamine®3.0试剂与靶向Factor VII(FVII)或PPIB mRNA的siRNA组成的复合物,以每千克小鼠体重1 mg(mg/kg)的注射量进行注射,最终靶向mRNA水平出现了高达85%的敲低(使用TaqMan®分析对敲低进行评估)。
仅需更少的siRNA即可实现高效敲低
使用不同量的siRNA与Invivofectamine® 3.0试剂的复合物通过静脉注射引入小鼠体内。在注射后24小时使用显色法对血清中的FVII蛋白含量进行检测(图3)。敲低水平与复合物中siRNA的含量正相关。Invivofectamine® 3.0试剂的ED50为0.1 mg/kg,相比而言之前的产品其水平为1.0 mg/kg。
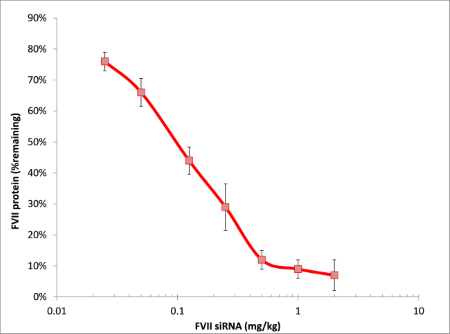
图3、Invivofectamine® 3.0试剂与靶向FVII的siRNA在单次静脉注射后可在肝脏中引起剂量反应的敲低现象。 Invivofectamine®
3.0试剂与靶向FVII的Ambion® in vivo siRNA以0.02到2 mg/kg的剂量进行注射。随后分离血清并检测FVII蛋白的水平(Biophen®显色检测
单次注射后具有持续敲低能力
单次注射Invivofectamine® 3.0试剂/siRNA复合物即可从第一天直到最多3周的时间内获得显著的敲低结果(图4)。提高siRNA在注射复合物中的含量可获得持续时间更长的敲低结果,可超出检测范围。
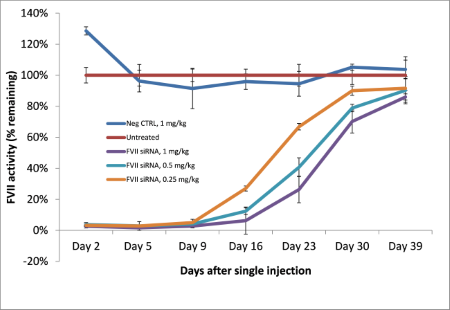
图4.使用三种不同浓度的靶向Factor VII (FVII)的siRNA研究剂量效应。siRNA分子与Invivofectamine® 3.0试剂形成复合物后分别以1、0.5、及0.25 mg/kg的剂量进行注射。在第2、5、9、16、23及30日收集血清,并使用显色法对血清进行分析以确定FVII蛋白的敲低效果。
体内基因表达的敲低导致预期中的表型变化
Apolipoprotein B(ApoB)是低密度脂蛋白(LDL)的主要载脂蛋白,可将胆固醇携带至组织中。相应地,对ApoB的表达降低程度进行监控的实验显示出胆固醇及甘油三酸酯水平的降低。通过高效的敲低作用,Invivofectamine® 3.0试剂与靶向ApoB的siRNA形成的复合物已表现出可特异性地使胆固醇及甘油三酸酯的水平降低(图5)。Invivofectamine® 3.0试剂的特异性及高效性使得研究人员更具有信心,即他们所观察到的表型可归因于特定的标靶敲低,而不是非特异性的毒性作用。
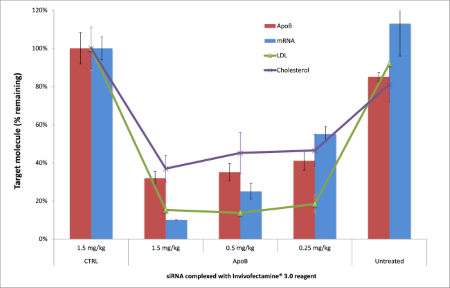
图5、Invivofectamine® 3.0试剂及靶向ApoB的siRNA在单次静脉注射后可在肝脏中达到敲低效果。 Invivofectamine® 3.0试剂与ApoB siRNA形成的复合物以1.5, 0.5,及0.25 mg/kg的剂量进行注射。以1.5 mg/kg siRNA的剂量注射复合物可在mRNA水平引起>80%的敲低,在蛋白水平可引起~70%的敲低。对血清进行分离并检测胆固醇及LDL的含量,结果表明ApoB蛋白的敲低会导致胆固醇及LDL的含量显著降低。
Invivofectamine® 3.0试剂融化后的稳定性
Invivofectamine® 3.0试剂推荐的长期保存温度为–20°C,不过我们已通过实验验证Invivofectamine® 3.0试剂可在融化后于4°C条件下保存至少14天(图6),从而使你可将实验延长数天而无需重新冷冻该试剂。如果有必要,这款试剂可反复冻融多达4次而不会造成性能损失(数据未显示)。
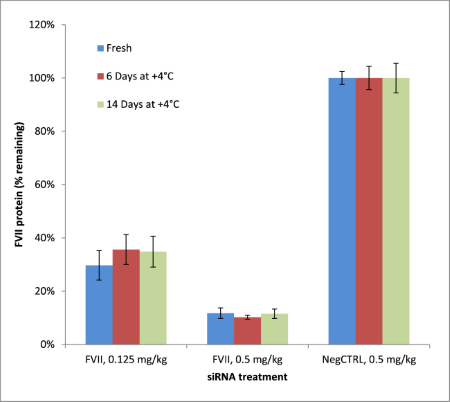
图6.保存于–20°C的Invivofectamine® 3.0试剂可进行融解并在4°C下保存多至14天。将Invivofectamine® 3.0 Reagent解冻并与FVII siRNA制得复合物,并随后以0.125及0.5 mg/kg的剂量进行静脉注射。 使用相同的融解试剂来制备用于首次注射后6及14天的第二次注射所需的复合物。当注射过每组siRNA之后,收集血液并对FVII蛋白含量水平进行评估(Biophen®显色检测)。结果表明解冻后并保存于4°C的Invivofectamine® 3.0试剂可在多至14天内正常使用,性能并未出现下降。
极低的体内毒性
为了评估Invivofectamine® 3.0试剂的体内毒性,在试剂注射后的多个时间点进行血液化学分析及细胞因子检测(图7及8)。结果表明在使用Invivofectamine® 3.0试剂进行转染的每个个体间所检测的生物标志物的水平与未注射该试剂的个体相比并没有显著差异。
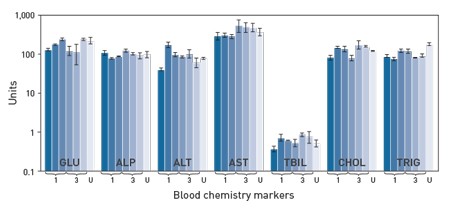
图7.对注射了Invivofectamine® 3.0试剂的小鼠样品进行血液化学分析。将Invivofectamine® 3.0试剂与靶向FVII的Ambion® in vivo siRNA的复合物分别以1 mg/kg [1], 3 mg/kg [3],或未处理[U]的剂量注射入小鼠体内。在注射后2、24及48小时收集血液样品,并通过临床化学检测方法对数个生物标志物(Antech)进行评估:葡萄糖(GLU, in mg/dL)、碱性磷酸酶(ALP, in U/L)、丙氨酸转氨酶(ALT, in U/L)、天冬氨酸转氨酶(AST, in U/L)、总胆红素(TBIL, in mg/dL)、胆固醇(CHOL, in mg/dL)、及甘油三酸酯(TRIG, in mg/dL)等。每条柱形图均包含来自4组平行重复的数据。
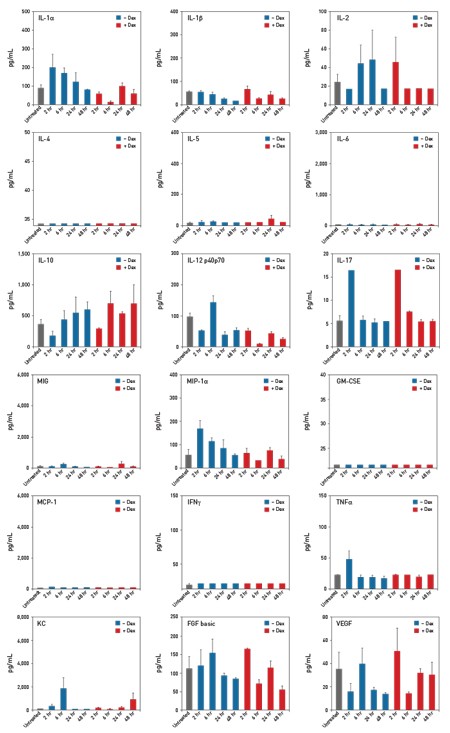
图8.小鼠注射Invivofectamine® 3.0试剂后进行取样细胞因子分析。 将Invivofectamine® 3.0试剂与靶向FVII的Ambion® in vivo siRNA的复合物以0.25 mg/kg的剂量进行注射(添加及未添加氟美松(Dex))。在注射后2、6、24及48小时后收集血液样品,并使用多通路磁珠法免疫检测试剂盒对细胞因子水平进行检测。将得自未经试剂处理的个体中的样品作为对照,使用相同的细胞因子panel法进行检测。每条柱形图均包含来自3组平行重复的数据。